Kleszcze to roztocze wielko┼Ťci kilku mm, kt├│rych samice po nassaniu si─Ö krwi mog─ů osi─ůga─ç d┼éugo┼Ť─ç ponad 1 cm. Atakuj─ů ludzi i zwierz─Öta tylko w celu pobrania pokarmu, co zapewnia im przekszta┼écenie si─Ö w kolejn─ů form─Ö rozwojow─ů lub z┼éo┼╝enie jaj przez samice. Cykl rozwojowy kleszczy przebiega wy┼é─ůcznie w ┼Ťrodowisku zewn─Ötrznym. W przeciwie┼ästwie np. do pche┼é, nie s─ů w stanie jednak rozwija─ç si─Ö w ┼Ťrodowisku domowym cz┼éowieka. P┼éodno┼Ť─ç samicy jest du┼╝a, poniewa┼╝ mo┼╝e ona z┼éo┼╝y─ç od 2 do 5 tys. jaj. Ca┼éy cykl rozwojowy trwa zwykle od 1-3 lat, a jego d┼éugo┼Ť─ç zale┼╝y od dost─Öpno┼Ťci pokarmu dla form rozwojowych (larw, nimf). Kleszcze maj─ů du┼╝e znaczenie epidemiologiczne i epizootiologiczne.
W Polsce wyst─Öpuje 21 z oko┼éo 810 gatunk├│w kleszczy (Ixodida) opisanych na ┼Ťwiecie. W Europie znanych jest ponad 60 gatunk├│w tych roztoczy (Siuda, 1991). Najcz─Ö┼Ťciej notowanym gatunkiem w Europie i w Polsce jest Ixodes ricinus.
Ixodes ricinus ÔÇô kleszcz pospolity
Dawniej nazywany kleszczem pastwiskowym, lub niekiedy b┼é─Ödnie kleszczem psim (Furmaga, 1983). Tr├│j┼╝ywicielowy gatunek o barwie cia┼éa od jasno- do ciemnobr─ůzowej. Samiec wielko┼Ťci 2-2,7 x1-1,5 mm, samica: 3-3,5x1,5-2 mm (ryc. 1). Gnatosoma d┼éugo┼Ťci 0,5-1 mm (ryc. 2). Po nassaniu si─Ö samica osi─ůga wielko┼Ť─ç 12x9 mm, upodobniaj─ůc si─Ö do nasiona r─ůcznika pospolitego (Ricinus communis) (ryc. 3). Zreszt─ů fakt ten nie tylko odcisn─ů┼é pi─Ötno na ┼éaci┼äskiej nazwie gatunku kleszcza lecz tak┼╝e na angielskiej - Castor bean tick. Castor bean to po angielsku r─ůcznik pospolity.

Ryc. 1
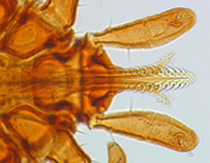
Ryc. 2

Ryc. 3
Kleszcz pospolity wyst─Öpuje powszechnie na terenie ca┼éej Polski. Najcz─Ö┼Ťciej w lasach li┼Ťciastych i mieszanych, w miejscach o wysokiej wilgotno┼Ťci wzgl─Ödnej (80-95%). Bardzo wra┼╝liwy na wysychanie, ma┼éo ruchliwy (przemieszcza si─Ö na odleg┼éo┼Ť─ç do kilku metr├│w), skupiaj─ůcy si─Ö wzd┼éu┼╝ le┼Ťnych ┼Ťcie┼╝ek i szlak├│w dzikich zwierz─ůt. Unikaj─ůcy ods┼éoni─Ötych, pozbawionych drzew i krzew├│w przestrzeni. Na obszarze Polski wykazuje aktywno┼Ť─ç od po┼éowy kwietnia do po┼éowy listopada (Siuda, 1993). We Wroc┼éawiu i okolicach obserwowano tak┼╝e zimowe (stycze┼ä/luty) inwazje Ixodes ricinus u ps├│w, szczeg├│lnie w s┼éoneczne dni, gdy temperatura powietrza waha┼éa si─Ö w granicach 7-12oC. Jest to zgodne z wcze┼Ťniejszymi obserwacjami, dzi─Öki kt├│rym oszacowano temperaturowy pr├│g aktywno┼Ťci postaci dojrza┼éych kleszcza pospolitego na 5oC, a nimf - 8oC (Kolpy, 1961).
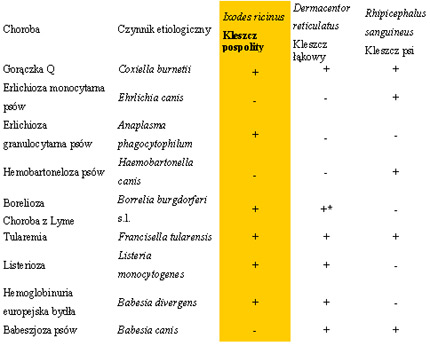
Ixodes ricinus ma najwi─Öksze znaczenie epidemiologiczne i epizootiologiczne ze wszystkich gatunk├│w kleszczy obserwowanych na terenie Polski. Zestawienie wszystkich dotychczas poznanych czynnik├│w chorobotw├│rczych, dla kt├│rych mog─ů by─ç wektorami I. Ricinus oraz Dermacentor reticulatus i Rhipicephalus sanguineus przedstawiono w tabelach 1 i 2.
Tab. 1 Wybrane gatunki kleszczy jako wektory chor├│b zaka┼║nych i inwazyjnych u ludzi z terenu Polski i Europy

Tab. 2 Wybrane gatunki kleszczy jako wektory chor├│b zaka┼║nych i inwazyjnych u zwierz─ůt z terenu Polski i Europy
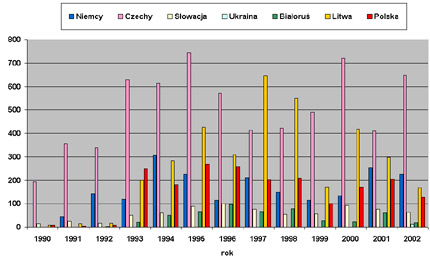
Według danych zebranych przez International Scientific Working group on TBE, w latach 1993-2002 w Polsce odnotowano znaczny wzrost zarejestrowanych przypadków kleszczowego zapalenia mózgu (KZM) u ludzi wywoływanego przez flavivirusa TBE przenoszonego przez kleszcza pospolitego (ryc. 5) (ISW-TBE, 2005).
Ryc. 5 Liczba zarejestrowanych przypadk├│w zachorowa┼ä ludzi na kleszczowe zapalenie m├│zgu (KZM) w Polsce i krajach s─ůsiednich w latach 1990-2002
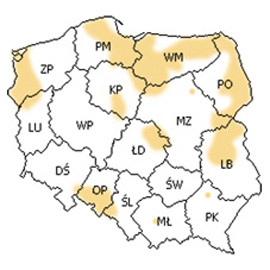
W latach 1990-1992 obserwowano w naszym kraju od 4 do 8 przypadk├│w, natomiast w latach 1993-2002 liczba zachorowa┼ä waha┼éa si─Ö od 101 do 267. G┼é├│wne rejony endemiczne wyst─Öpowania tej choroby znajduj─ů si─Ö w p├│┼énocno-wschodniej Polsce (ryc. 4).
Ryc. 4
Zachorowania na KZM zarejestrowane w wojew├│dztwie bia┼éostockim w latach 1993-1998 oraz w wojew├│dztwie podlaskim w latach 1999-2002 stanowi┼éy odpowiednio 43% i 46% wszystkich przypadk├│w zachorowa┼ä na KZM w Polsce (Kondrusik i wsp., 2004). Bior─ůc pod uwag─Ö liczb─Ö zachorowa┼ä ludzi na kleszczowe zapalenie m├│zgu odnotowanych w latach 2000-2002, w krajach s─ůsiaduj─ůcych z Polsk─ů (170-205 przypadk├│w) nale┼╝y podkre┼Ťli─ç, ┼╝e powa┼╝niejsz─ů sytuacj─Ö epidemiologiczn─ů maj─ů Czechy (411-719 przypadk├│w) i Litwa (168-419 przypadk├│w) oraz zbli┼╝on─ů do krajowej ÔÇô Niemcy (133-253 przypadk├│w). W roku 2001 w┼Ťr├│d 48 przypadk├│w KZM hospitalizowanych w Klinice Chor├│b Zaka┼║nych i Neuroinfekcyjnych AM w Bia┼éymstoku, w odr├│┼╝nieniu od lat poprzednich, nie by┼éo pracownik├│w le┼Ťnych, co mo┼╝e ┼Ťwiadczy─ç o skuteczno┼Ťci wprowadzonych szczepie┼ä (Grygorczuk, 2002).
Chorob─Ö z Lyme (borelioz─Ö) wywo┼éuje kr─Ötek Borrelia burgdorferi sensu lato (s.l.). G┼é├│wnym wektorem tego drobnoustroju w Europie jest kleszcz I. Ricinus. Zapadaj─ů na ni─ů mi─Ödzy innymi ludzie i zwierz─Öta towarzysz─ůce, natomiast u zwierz─ůt dziko┼╝yj─ůcych zwykle przebiega bezobjawowo. W Polsce notuje si─Ö rocznie 9-10 przypadk├│w na 100 tys. mieszka┼äc├│w (w 1996 r. w stanie Connecticut, USA, na obszarze 12 miast, w tym Lyme i Old Lyme, zanotowano 94 przypadki na 100 tys. os├│b (Stafford III i wsp., 1998)). Jest to liczba nawet dziesi─Öciokrotnie mniejsza ni┼╝ w krajach s─ůsiednich. Wed┼éug opinii Pa┼ästwowego Zak┼éadu Higieny s─ů to dane zani┼╝one, wynikaj─ůce z mniejszej wykrywalno┼Ťci tej jednostki chorobowej. Nie zawsze obserwuje si─Ö klasyczny przebieg boreliozy z rumieniem w─Ödruj─ůcym, pojawiaj─ůcym si─Ö w miejscu wk┼éucia kleszcza po 3-30 dniach (najcz─Ö┼Ťciej pomi─Ödzy 7 a 10 dniem) od momentu zaka┼╝enia kr─Ötkiem. U 15% chorych rumie┼ä w─Ödruj─ůcy mo┼╝e si─Ö w og├│le nie pojawi─ç (Hengge i wsp., 2003). Do zaka┼╝enia B. Burgdorferi s.l. dochodzi zwykle po 2-3 dniach od chwili wk┼éucia si─Ö kleszcza. Stwierdzano tak┼╝e szybciej nast─Öpuj─ůce zaka┼╝enia, ju┼╝ po 17 czy 29 godz. (Humair i Gern, 2000).
W przenoszeniu kr─Ötka ze zwierz─ůt dziko┼╝yj─ůcych (drobne gryzonie, dzikie prze┼╝uwacze) na ludzi i zwierz─Öta towarzysz─ůce najwi─Öksz─ů rol─Ö odgrywaj─ů postacie dojrza┼ée i nimfy I. Ricinus. W Polsce, w okolicach Szczecina B. Burgdorferi s.l. stwierdzano u 15,5% nimf i 36,4% doros┼éych postaci, w okolicach Katowic i Tarnowa u 16,7% nimf, u 28,3% samic i 12,5% samc├│w, w okolicach Gda┼äska, Sopotu i Gdyni u 7,0% nimf, u 24,3% samic i 13,7% samc├│w I. Ricinus (Kosik-Bogacka iwsp., 2004, Petko i wsp., 1997, Sta┼äczak i wsp., 2004). Badania przeprowadzone w Czechach, w latach 1991-2001 wykaza┼éy, ┼╝e B. Burgdorferi s.l. by┼éo zara┼╝onych 26,1% samc├│w, 24,9% samic i 16,8% nimf kleszcza pospolitego. Kleszcz pastwiskowy mo┼╝e zaka┼╝a─ç si─Ö borelioz─ů nie tylko pobieraj─ůc pokarm od zaka┼╝onego zwierz─Öcia lub cz┼éowieka ale tak┼╝e wtedy, gdy na zdrowym ┼╝ywicielu od┼╝ywia si─Ö w obecno┼Ťci innego zaka┼╝onego kr─Ötkiem kleszcza (co-feeding transmission). Odleg┼éo┼Ť─ç pomi─Ödzy ┼╝eruj─ůcymi kleszczami nie powinna jednak przekracza─ç 1 cm (Randolph i wsp., 1996).
U zwierz─ůt towarzysz─ůcych, w tym ps├│w i kot├│w, stwierdza si─Ö tak┼╝e borelioz─Ö. Na terenie Europy seroprewalencja B. Burgdorferi s.l. u kot├│w wynosi 33%, natomiast u ps├│w waha si─Ö od 5,8 do 53,7%. Zachodzi wi─Öc domniemanie, ┼╝e ich w┼éa┼Ťciciele przy obecno┼Ťci w najbli┼╝szym otoczeniu kleszczy powinni by─ç bardziej nara┼╝eni na zaka┼╝enie t─ů chorob─ů. Jak dotychczas nie ma wiarygodnych danych potwierdzaj─ůcych lub bezwzgl─Ödnie wykluczaj─ůcych t─ů tez─Ö. Owszem, stwierdzono zbli┼╝on─ů seroprewalencj─Ö B. Burgdorferi s.l. u ps├│w my┼Ťliwskich i ich w┼éa┼Ťcicieli, jednak t┼éumaczy si─Ö ten fakt jednoczesnym przebywaniem ludzi i zwierz─ůt na obszarach zwi─Ökszonego ryzyka (lasy). Monitoring seropozytywno┼Ťci ps├│w mo┼╝e by─ç dobrym wska┼║nikiem dla prognozowania ryzyka wyst─ůpienia boreliozy na danym terenie (Bhide i wsp., 2004).
Coraz cz─Ö┼Ťciej u ludzi i zwierz─ůt pojawiaj─ů si─Ö zaka┼╝enia nowymi, dotychczas nie notowanymi na danym terenie gatunkami patogen├│w przenoszonymi przez kleszcze lub te┼╝ s─ů to przypadki infekcji (inwazji) wielogatunkowych (tab. 1 i 2) (Shaw i wsp., 2001, Sroka i wsp., 2003, Sta┼äczak i wsp., 2004). Obserwowano np. przypadek kobiety w ci─ů┼╝y, u kt├│rej wyst─ůpi┼éy objawy boreliozy wsp├│┼éistniej─ůcej z ludzk─ů granulocytarn─ů erlichioz─ů (Brzostek, 2004) lub przypadek psa (1,5 roczny owczarek niemiecki), u kt├│rego stwierdzono zar├│wno babeszjoz─Ö, jak i borelioz─Ö (badania w┼éasne autora). Taki stan rzeczy wynika mi─Ödzy innymi z wielo┼╝ywicielowo┼Ťci zdecydowanej wi─Ökszo┼Ťci gatunk├│w kleszczy, oraz z inwazji wielogatunkowych tych paso┼╝ytniczych roztoczy u zwierz─ůt i ludzi. Ma na to wp┼éyw tak┼╝e wzrost populacji dzikich zwierz─ůt i coraz cz─Östsze wkraczanie cz┼éowieka na ich tereny w celach gospodarczych i rekreacyjnych, co zwi─Öksza ryzyko zaka┼╝enia chorob─ů odzwierz─Öc─ů przenoszon─ů przez kleszcze. Prawdopodobnie nie bez znaczenia s─ů r├│wnie┼╝ subkliniczne infekcje u zwierz─ůt towarzysz─ůcych, kt├│re staj─ů si─Ö rezerwuarem wielu patogen├│w (Shaw i wsp., 2001). Obecnie szczeg├│lnego wi─Öc znaczenia nabiera zapobieganie inwazjom kleszczy oraz ich zwalczanie.
Dr n. wet. Andrzej Połozowski
Zak┼éad Parazytologii, Katedra Chor├│b Wewn─Ötrznych i Paso┼╝ytniczych z Klinik─ů Chor├│b Koni, Ps├│w i Kot├│w, AR, Wroc┼éaw
Literatura:
1. Bhide M., Travnicek M., Curlik J., Stefancikova A., 2004. The importance of dogs in eco-epidemiology of Lyme borreliosis: a review. Vet. Med. ÔÇô Czech, 49, 4, 135-142.
2. Brzostek T., 2004. Ludzka erlichioza granulocytarna wsp├│┼éistniej─ůca z borelioz─ů z Lyme u kobiety ci─Ö┼╝arnej. Przegl. Epidemiol., 58, 2, 289-294.
3. Furmaga S., 1983: Chroby paso┼╝ytnicze zwierz─ůt domowych. PWRiL, Warszawa, 43.
4. Grygorczuk S., Mierzyńska D., Zdrodowska A., Zajkowska J., Pancewicz S., Kondrusik M., Świerzbińska R., Pryszmont J., Hermanowska-Szpakowicz T., 2002. Przegl. Epidemiol., 56, 4, 595-604. 5. Hengge U. R., Tannapfel A., Tyring S. K., Erbel R., Arendt G., Ruzicka T., 2003. Lyme borreliosis. The Lancet, Infectious Diseases, 3, 489-500.
6. Hubalek Z., Halouzka J., Juricova Z., 2003. Longitudinal surveillance of the tick Ixodes ricinus for borreliae. Medical and Vet. Entomology, 17, 46-51.
7. Humair P-F., Gern L., 2000. The wild hidden face of Lyme borreliosis in Europe. Microbes and Infection, 2, 915-922.
8. International Scientific Working group on TBE, 2005. www.tbe-info.com/epidemiology/index.html.
9. Kolpy I., 1961. Obserwacje nad rozprzestrzenieniem i aktywno┼Ťci─ů Ixodes ricinus L. na terenie Pojezierza Warmi┼äsko-Mazurskiego. Wiad. Parazytol., 7, 915-918.
10. Kondrusik M., Biedzińska T., Pancewicz S., Zajkowska J., Grygorczuk S., Świerzbińska R., Saniutycz-Kuroczycki S., Hermanowska-Szpakowicz T., 2004. Zachorowania na kleszczowe zapalenie mózgu (KZM) w województwie białostockim i podlaskim w latach1993-2002. Przegl. Epidemiol., 58, 2, 273-280.
11. Kosik-Bogacka D., Ku┼║na-Grygiel W., Bukowska K., 2004. The prevalence of spirochete Borrelia burgdorferi sensu lato in ticks Ixodes ricinus and mosquitos Aedes spp. within a selected recreational area in the city of Sczecin. Ann. Agric. Environ. Med. , 11, 105-108.
12. Petko B., Siuda K., Stanko M., Tresova G., Karbowiak G., Fricova J., 1997. Borrelia burgdorferi sensu lato in the Ixodes ricinus ticks in Southern Poland. Ann. Agric. Environ. Med. , 4, 263-269.
13. Randolph S. E., Gern L., Nuttall P. A., 1996. Co-feeding ticks: epidemiological significance for tick-born pathogen transmission. Parasitology Today, 12, 12, 472-479.
14. Shaw S. E., Day M. J., Birtles R. J., Breitschwerdt E. B., 2001. Tick-borne infectious diseases of dogs. Trends in Parasitology, 17, 2, 74-80.
15. Siuda K., 1991: Kleszcze (Acari: Ixodida) Polski. Cz─Ö┼Ť─ç I. Zagadnienia og├│lne. Monografie Parazytologiczne. PWN, Warszawa, Wroc┼éaw.
16. Siuda K., 1993: Kleszcze (Acari: Ixodida) Polski. Cz─Ö┼Ť─ç II. Systematyka i rozmieszczenie. Monografie Parazytologiczne, 12. PTP, Warszawa.
17. Sroka J., Chmielewska-Badora J., Dutkiewicz j., 2003. Ixodes ricinus as a potential vector of Toxoplasma gondii. Ann. Agric. Environ. Med. , 10, 121-123.
18. Stafford III K. C., Cartter M. L., Magnarelli L. A., Ertel S-H., Mshar P. A., 1998. Temporal correlations between tick abundance and prevalence of ticks infected with Borrelia burgdorferi and increasing incidence of Lyme disease. J. Clinical Microbiology, 36, 5, 1240-1244.
19. Stańczak J., Gabre R. M., Kruminis-Łozowska W., Racewicz M., Kubica-Biernat B., 2004. Ixodes ricinus as a vector of Borrelia burgdorferi sensu lato, Anaplasma phagocytophilum and Babesia microti in urban and suburban forests. Ann. Agric. Environ. Med. , 11, 109-114.
Poinformuj kolege
|
Wersja do druku
|
Send this article
|











